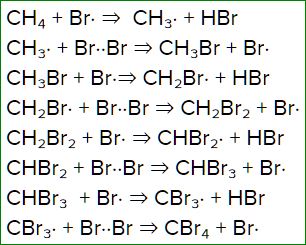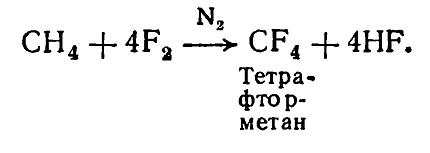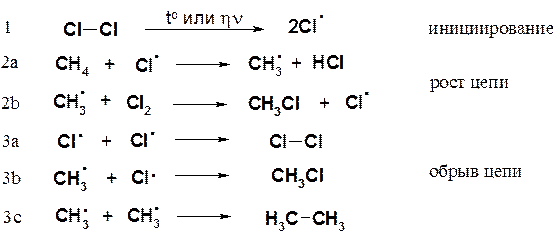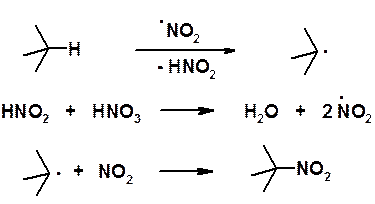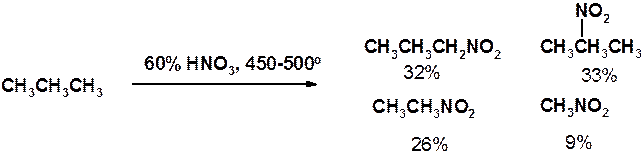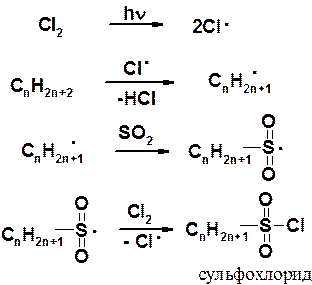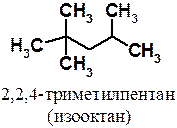Хлорирование и бромирование метана. Механизм реакции
Хлорирование метана происходит при освещении ультрафиолетовым светом или при повышенной температуре 250 — 400 о С.
Реакция протекает по следующей схеме:
На первой стадии молекула хлора распадается на два атома. Альтернативная возможность разрыва молекулы хлора с образованием ионов хлора (гетеролитический разрыв) не может осуществиться, поскольку для этого требуется значительно большая энергия.
Каждый атом хлора, образующийся в результате гомолитического разрыва связи, сохраняет один электрон из пары, за счет которой осуществлялась ковалентная связь.
| Aтом или грyппa, имeющaя нecпaренный электрон, называется свободным радикалом. Неспаренный электрон обозначают точкой. |
Атом хлора, как и большинство свободных радикалов, очень реакционноспособен, так как он стремится получить еще один электрон для завершения электронной оболочки.
Атом хлора реагирует с теми частицами, которые окружают его и находятся в большой концентрации: молекулами хлора и метана. Столкновение с молекулой хлора не приводит к образованию новых частиц, а столкновение с молекулой метана приводит к возникновению нового радикала. Атом хлора вырывает атом водорода с его электроном, и образуется новый радикал Н3C · (реакция 2). Теперь уже атом углерода имеет неспаренный электрон. Так же, как и атом хлора, он стремится завершить электронную оболочку. И вновь радикал Н3C · реагирует с частицами, находящимися вокруг него в большинстве: с метаном, но это взаимодействие не дает новых частиц, и с хлором, что приводит к образованию хлористого метила и атома хлора (реакция 3).
В реакциях (2) и (3) исчезновение одного радикала сопровождается образованием нового радикала. Реакции (2) и (3) повторяются.
При обрыве цепи реакционная способность реагирующих частиц утрачивается ввиду рекомбинации (объединения) атомов и свободных радикалов в валентно насыщенные молекулы (реакции 4, 5, 6). Поэтому для поддержания реакции требуется постоянное инициирование. В результате рекомбинации двух свободных метильных радикалов образуется побочный продукт — этан. Содержание этана в реакционной смеси невелико, так как стационарная концентрация метильных радикалов, создаваемая в условиях реакции, ничтожна мала.
При хлорировании метана одна реакция инициирования вызывает последовательность реакций, в каждой из которых регенерируется реакционноспособная частица — радикал, вызывающий следующую стадию. Такой механизм называется радикально-цепным. В благоприятных условиях хлорирование метана может пройти от 100 до 10000 циклов прежде, чем произойдет обрыв цепи.
Скорость цепной реакции сильно снижается в присутствии соединений, которые взаимодействуют с радикалами и превращают их в малореакционноспособные частицы. Такие вещества называют ингибиторами. Например, кислород действует как ингибитор. Радикал СН3-О-О · значительно менее реакционноспособен, чем радикал Н3C · , и не может продолжать цепь.
Источник
Бромирование, йодирование и фторирование метана
Что такое бромирование, йодирование и фторирование метана
Процессы бромирования, фторирования и йодирования метана относятся к химическим реакциям замещения или галогенирования с радикальным механизмом замещения. Процесс реакции протекает или на свету, или при облучении УФ-светом, или при нагревании. Реакция идет поэтапно. На одном этапе замещается один атом углерода в молекуле.
Основными стадиями реакции галогенирования метана являются следующие:
- Инициация цепи: \(Br_ <2>\rightarrow Br + Br.\)
- Развитие цепи: \(CH_ <2>+ Br \rightarrow CH_ <3>+ HBr; CH_ <3>+ Br_ <2>\rightarrow CH_<3>Br + Br.\)
- Обрыв цепи: \(2Br \rightarrow Br_<2>; Br + CH_ <3>\rightarrow CH_<3>Br; CH_ <3>+ CH_ <3>\rightarrow CH_<3>—CH_<3>.\)
Правило Марковникова гласит, что при присоединении галогеноводородов или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному углеродному атому, т. е. к атому углерода, связанному с большим числом атомов водорода. При этом атом галогена или группа —ОН присоединяется к наименее гидрогенизированному.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Название правилу было дано в честь русского химика В.В. Марковникова, сформулировавшего его в 1869 году.
Действие правила Марковникова можно наблюдать на втором этапе галогенизирования метана, когда галоген присоединяется к метильной группе \(CH_<3>\) , степень гидрогенизации которой самая низкая.
Бромирование метана, как протекает на свету
Продуктами бромирования метана являются бромметан, бромоводород, четырехбромистый углерод.
По сравнению с хлорированием, процесс протекает не так активно, но остановить начавшуюся реакцию уже нельзя. При бромировании получается смесь из всех возможных продуктов реакции, состав получившейся смеси будет зависеть от изначальных пропорций метана и брома.
Полная схема реакции бромирования метана:
\(CBr_<4>\) здесь — четырехбромистый углерод.
Фторирование метана с помощью \(CoF_<3>\)
Фторировать метан прямой реакцией со фтором нельзя из-за бурной экзотермической реакции. Если не предпринимать дополнительных мер по сдерживанию реакции, то газофазное фторирование может привести к взрыву. Поэтому оно редко применяется.
Куда чаще метан фторируют при помощи смеси фторида кобальта (III) \(CoF_<3>\) и чистого \(F_<2>\) в инертной среде, например, в азоте, при нагреве до \(200–300\circ С\) .
Формула реакции выглядит так:
Путем этой реакции получают перфторалканы, использующиеся для разделения изотопов урана-235 и урана-238 в виде летучих гексафторидов 235UF6 и 238UF6, и фторид кобальта (II). Также продуктами реакции фтора и метана являются фреоны, используемые для охлаждения техники.
Йодирование метана
Прямое йодирование метана осуществить практически нереально, потому что реакция идет очень медленно даже при нагреве до \(300–5000\circ С\) . Рост цепи, несмотря на то, что ее инициация происходит даже легче, чем при бромировании или фторировании, в этом случае довольно эндотермический процесс, который и тормозит дальнейшие превращения.
Но если добавить к смеси окислитель для связывания HI, то реакция возможна:
Однако проще всего получить йодированный метан путем реакции метанола с трииодидом фосфора. Уравнение реакции в этом случае выглядит так:
\(3CH_<3>OH + PI_ <3>\rightarrow 3CH_<3>I + H_<3>PO_<3>.\)
Источник
Механизм реакции галогенирования алканов



Поскольку хлорирование и бромирование метана и других алканов протекает по одному механизму, его знание обеспечит понимание всех реакций галогенирования алканов. Как уже было отмечено выше, механизм реакции должен объяснять известные экспериментальные факты.
В реакции хлорирования метана механизм не должен противоречить следующим фактам:
— смесь метана и хлора не реагирует в темноте при комнатной температуре;
— реакция протекает в темноте при температурах выше 250 о С;
— реакция протекает при комнатной температуре при обучении реакционной смеси ультрафиолетовым светом;
— реакция может протекать в темноте при комнатной температуре или незначительном нагревании в присутствии соединений, способных в этих условиях генерировать свободные радикалы (например, Pb(C2H5)4);
— если реакция протекает при ультрафиолетовом облучении, то она имеет высокий квантовый выход (на каждый поглощенный системой фотон образуется несколько тысяч молекул хлористого метила);
— присутствие в реакционной смеси кислорода замедляет реакцию. Длительность периода замедления зависит от количества кислорода в смеси.
Следующий механизм свободнорадикального замещения полностью объясняет приведенные выше факты:
На первой стадии реакции (инициирование) под действием ультрафиолетового облучения или нагрева происходит гомолитический разрыв связи в молекуле хлора. Энергия этой связи — 58 ккал/моль (242,83 кДж/моль) — наименьшая среди участвующих в реакции молекул. В результате разрыва связи в молекуле галогена образуется атомарный хлор, имеющий неспаренный электрон и обладающий очень высокой реакционной способностью.
Столкновение атома хлора с молекулой метана приводит к отрыву от последней атома водорода и образованию метильного радикала (стадия 2а). Образовавшийся свободный метильный радикал имеет лишь семь электронов и, стремясь к электронному октету и уменьшению энергии за счет образования связи, проявляет очень высокую реакционную способность.
Далее метильный радикал отрывает от молекулы хлора атом со связывающим электроном, образуя хлористый метил (стадия 2b). В реакционной массе вновь генерируется свободный атом хлора.
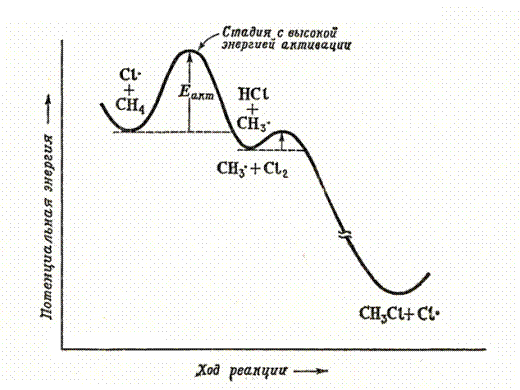
Рис 6.1. Энергетическая диаграмма хлорирования метана
Рассмотренная реакция является не просто реакцией свободнорадикального замещения (SR), а цепным процессом. Цепной называется реакция, которая включает ряд стадий, на каждой из которых образуется частица, вызывающая следующую стадию. Единственную отечественную Нобелевскую премию по химии за исследования цепных реакций получил академик Н.Н. Семенов (1956 г.).
Стадии роста цепи (2a и 2b) не могут продолжаться бесконечно. Стадии, в которых радикальные частицы не генерируются, называются стадиями обрыва цепи (рекомбинация свободных радикалов) и показаны выше на схеме (3a-c).
Данный механизм объясняет все приведенные выше экспериментальные факты.
Галогенирование высших алканов протекает по тому же механизму, что и галогенирование метана. Реакция осложняется тем, что, начиная с пропана, возможно образование изомерных галогенопроизводных.
Рассмотрим бромирование метилбутана (см. схему). В этой реакции возможно образование четырех монобромпроизводных I-IV. Соединения I и IV являются первичными бромопроизводными, II – третичными, а III – вторичными. Учитывая, что в молекуле метилбутана 1 третичный, 2 вторичных и 9 первичных атомов водорода, то при одинаковых скоростях реакций по этим положениям следует ожидать соотношение изомеров I и IV : III : II = 9 : 2 : 1. Однако в опыте образуется смесь с другим соотношением изомеров. В результате бромирования получено более 95 % соединения II, около 5 % соединения III и следы соединений I и IV.
Такой результат реакции позволяет сделать вывод, что бромирование по третичному атому происходит быстрее, чем по вторичному, а по вторичному, в свою очередь, быстрее, чем по первичному. Поскольку стадией, определяющей скорость галогенирования, является образование алкильного радикала (см. рис. 6.1.), легкость образования свободных радикалов уменьшается в ряду:
третичный > вторичный > первичный > метильный
В той же последовательности снижается и стабильность радикальных частиц. Общая закономерность органической химии: чем устойчивее частица, тем легче она образуется. Этот вывод относится к свободным радикалам, катионам и анионам.
Причина указанного выше изменения стабильности свободных радикалов заключается в делокализации неспаренного электрона, находящегося на p-орбитали и состоящего в сопряжении с электронами s-связей. Чем больше разветвлена углеродная цепь у атома, несущего неспаренный электрон, тем выше стабильность радикала и, следовательно, тем легче и быстрее он образуется.
Относительные скорости бромирования по третичному, вторичному и первичному атомам углерода относятся как 1600 : 82 : 1. В реакции хлорирования та же закономерность. Однако хлор значительно более реакционноспособный, следовательно, менее избирательный (селективный) реагент, поэтому разница в скоростях не столь значительна и составляет 5,0 : 3,8 : 1,0 соответственно. Поэтому реакция хлорирования всегда приводит к сложным смесям продуктов монохлорирования. Поэтому, если в ходе решения задачи нужно получить моногалогенопроизводное прямым галогенированием алкана, следует проводить реакцию бромирования.
Как уже было отмечено выше, реакционная способность алканов низка. Наряду с хлорированием и бромированием можно отметить еще лишь несколько реакций. В 1888 г. М.И. Коновалов описал реакцию жидкофазного нитрования алканов. Реакция Коновалова протекает при 100-150 о С под действием 10-15 % азотной кислоты.
Жидкофазное нитрование протекает с низким выходом и в 1934 г. было модифицировано Г.Б. Хаасом, который предложил проводить нитрование в паровой фазе (реакция Коновалова-Хааса).
Реакция протекает по радикальному механизму. Хотя легкость замещения водорода при нитровании изменяется в обычной последовательности третичный > вторичный > первичный > метильный, реакция сопровождается деструкцией с образованием всех возможных мононитропроизводных.
Среди функционализированных алканов важное место занимают сульфопроизводные (СМС). Концентрированная серная кислота действует на низшие алканы как окислитель и прямое сульфирование возможно лишь в случае высших производных. Для введения в молекулу предельного углеводорода сульфогруппы обычно используют обходной путь, применяя реакцию сульфохлорирования (действие SO2+Cl2) или сульфоокисление (SO2+O2).
При освещении ультрафиолетовым светом парафины вступают в реакцию замещения со смесью хлора и оксида серы (IV) с образованием сульфохлоридов.
Реакция протекает по цепному механизму. Стадия инициирования – гомолитическое расщеплении молекулы хлора.
Одним из наиболее важных направлений использования алканов является применение их в качестве топлива. Пламенное окисление алканов в присутствии кислорода воздуха приводит к их полному сгоранию до углекислого газа и воды с выделением большого количества тепла.
Механизм этой реакции до конца не установлен, несмотря на наличие большого числа математических моделей. Нет сомнений, что это свободнорадикальная цепная реакция.
При сжатии смеси паров бензина, состоящего из алканов, с воздухом образуются перекисные соединения, вызывающие так называемую «детонацию». Легче всего образуют перекиси алканы нормального строения, из которых состоит так называемый «бензин прямой гонки». Значительно лучшие антидетонационные свойства имеют алканы, в структуре которых есть четвертичный атом углерода. В основу условной шкалы оценки моторных топлив был положен изооктан (2,2,3-триметилпентан), которому было приписано октановое число 100, а н-гептану, обладающему сильными детонационными свойствами, — 0. Следует отметить, что имеются топлива, имеющие октановое число и больше 100. Бензин марки АИ-95 имеет точно такие же антидетонационные свойства, как смесь 95% изооктана и 5% н-гептана.
Химической промышленности необходимо большее количество низших углеводородов, чем может быть извлечено из углеводородного сырья. Алканы подвергаю пиролизу (от греческих слов pyr – огонь и lisis – разрушение), т.е. термическому разложению. Пиролиз алканов называют крекингом. Термический крекинг состоит в пропускании алканов через металлическую колонку, нагретую до высокой температуры (от 450 до 900 о С). При этом высшие алканы превращаются в насыщенные соединения с меньшим молекулярным весом, алкены и водород. В качестве примера приведем крекинг пропана, приводящий к образованию пропилена, этилена, метана и водорода.
Источник