- Прибор кротова техника безопасности
- Санитарно-бактериологическое исследование воздуха — Ф. К. Черкес
- Методы отбора проб воздуха
- Контрольные вопросы
- Задача
- Задание
- Методы отбора проб воздуха и приборы
- Вернуться в «Каталог СНиП»
- МУК 4.2.1775-03 Метод микробиологического измерения концентрации клеток микроорганизма Trichoderma viride 44-11-62/3 — продуцента комплекса целлюлолитических ферментов в атмосферном воздухе населенных мест.
- УТВЕРЖДАЮ
- 1. Общие положения и область применения
- 2. Характеристика штамма-продуцента Trichoderma viride 44-11-62/3
- 3. Пределы измерений
- 4. Метод измерений
- 5. Средства измерений, вспомогательные устройства, реактивы и материалы
- 6. Требования безопасности
- 7. Требования к квалификации операторов
- 8. Условия измерений
- 9. Проведение измерения
- 10. Вычисление результатов измерения
- 11. Оформление результатов измерений
Прибор кротова техника безопасности
Санитарно-бактериологическое исследование воздуха — Ф. К. Черкес
Среди факторов окружающей среды, влияющих на жизнь человека, воздух занимает ведущее место. Наука, изучающая микрофлору воздуха, называется аэромикробиологией.
Воздух не является благоприятной средой для развития микроорганизмов, так как не содержит питательных веществ и находится в постоянном движении. Поэтому большинство микроорганизмов быстро исчезают из воздуха. Однако некоторые из них более устойчивые, например туберкулезная палочка, споры клостридий, грибов и другие, могут длительно сохраняться в воздухе.
В воздухе городов микроорганизмов больше, чем в воздухе лесов и полей.
Количество микроорганизмов в воздухе с высотой уменьшается. Например, на высоте 500 м над Москвой в 1 м 3 воздуха обнаруживают 2-3 бактерии, а на высоте 1000 м — вдвое меньше.
Количество микроорганизмов в помещениях обычно больше, чем в воздухе открытых мест.
ГОСТ не нормирует методы проведения исследования воздуха. Раньше большое внимание уделялось определению гемолитических стрептококков как показателей загрязнения воздуха закрытых помещений микрофлорой, находящейся в носоглотке человека. В настоящее время больше внимания уделяют непосредственному обнаружению в воздухе патогенных и условно-патогенных микроорганизмов.
Санитарно-бактериологическое исследование воздуха проводят в плановом порядке: в больницах, операционных, детских учреждениях и др.
При санитарно-бактериологическом исследовании определяют:
1. Общее количество бактерий в 1 м 3 воздуха.
2. Наличие патогенных и условно-патогенных микроорганизмов в 1 м 3 воздуха.
Выявление микроорганизмов в воздухе проводится при помощи специальных приборов и специальных сред (диагностических и дифференциально-диагностических).
Методы отбора проб воздуха
Существуют два основных способа отбора проб воздуха для исследования: 1) седиментационный — основан на механическом оседании микроорганизмов; 2) аспирационный — основан на активном просасывании воздуха (этот метод дает возможность определить не только качественное, но и количественное содержание бактерий).
Чашки Петри с питательной средой (МПА) устанавливают в открытом виде горизонтально, на разном уровне от пола. Метод основан на механическом оседании бактерий на поверхность агара в чашках Петри. Чашки со средой экспонируют от 10 до 20 мин, в зависимости от предполагаемого загрязнения воздуха. Для выявления патогенной флоры используют элективные среды. Экспозиция в этих случаях удлиняется до 2-3 ч. После экспозиции чашки закрывают, доставляют в лабораторию и ставят в термостат на 24 ч при температуре 37° С. На следующий день изучают выросшие колонии. Метод этот используют в основном в закрытых помещениях.
Бактериоуловитель Речменского. Перед работой прибор заполняют стерильной содой. Действие прибора основано на протягивании через него воздуха с помощью аспиратора. При этом происходит распыление находящейся в приборе жидкости. После окончания просасывания жидкость, через которую был пропущен воздух, засевают по 0,1-0,2 мл на МПА в чашках Петри. При необходимости использовать элективные среды посевную дозу увеличивают (0,3-0,5 мл). Полученная в приемнике жидкость может быть использована для заражения животных (например, при исследованиях, проводимых для выявления вирусов, риккетсий и т. д.).
Прибор Дьяконова также основан на улавливании бактерий в жидкости, через которую пропущен воздух.
Прибор ПАБ-1 предназначен для бактериологического исследования больших объемов воздуха в течение короткого промежутка времени. Получение проб воздуха производят со скоростью 125-150 л/мин. Принцип работы прибора основан на улавливании микроорганизмов на электрод противоположного заряда. Большая скорость отбора проб воздуха в этом приборе и возможность посева его на различные питательные среды имеет значение для обнаружения патогенных и условно-патогенных бактерий (например, синегнойной палочки в хирургических отделениях и др.).
Аппарат Кротова. Действие основано на принципе удара струи воздуха на среду в чашках Петри. Аппарат состоит из трех частей: узла для отбора проб воздуха, ротаметра, электрической части питающего механизма.
Исследуемый воздух при помощи центробежного вентилятора, вращающегося со скоростью 4000-5000 об/мин, засасывается в щель прибора и ударяется о поверхность открытой чашки Петри со средой. Содержащиеся в воздухе микроорганизмы оседают на питательный агар. Для равномерного распределения микроорганизмов по всей поверхности столик с находящейся на нем чашкой вращается. Из прибора воздух выводится через воздухопроводную трубку, которая соединена с ротаметром, показывающим скорость протягивания воздуха через прибор.
Недостатком прибора Кротова является то, что он нуждается в электроэнергии, поэтому не во всех условиях может быть использован.
Отобранные пробы помещают в термостат при 37° С на 18-24 ч.
Чашку вынимают из термостата и производят подсчет колоний. Бактериальное загрязнение воздуха выражается общим числом микробов в 1 м 3 его.
Расчет. Например, за 10 мин пропущено 125 л воздуха, на поверхности выросло 100 колоний.
Для определения золотистого стафилококка забор производят на желточно-солевой агар. Чашки с посевами инкубируют в термостате при 37° С в течение 24 ч и 24 ч выдерживают при комнатной температуре для выявления пигмента. Колонии, подозрительные на S. aureus, подлежат дальнейшей идентификации (см. главу 14).
В детских учреждениях воздух проверяют на наличие сальмонелл. Для этого воздух засевают в чашку со средой висмут-сульфитный агар.
Выявление патогенных бактерий и вирусов в воздухе закрытых помещений проводят по эпидемиологическим показаниям. Для выявления возбудителей туберкулеза пользуются прибором ПОВ, в качестве улавливающей используется среда Школьниковой.
Контрольные вопросы
1. Является ли воздух благоприятной средой для развития микроорганизмов?
2. В каких учреждениях проводят плановое исследование микрофлоры воздуха?
3. Расскажите устройство аппарата Кротова.
Задача
За 10 мин было пропущено 250 л воздуха. Выросло 150 колоний. Рассчитайте количество колоний в 1 м воздуха.
Задание
Возьмите 4 чашки Петри со средой МПА, откройте их и установите на разном уровне от пола. Через 20 мин закройте чашки и поставьте в термостат. На следующий день подсчитайте количество выросших колоний, определите степень загрязнения воздуха.
Когда проститутки Набережных Челнов были готовы порадовать тебя своими выдающимися способностями в постели. Лучшие восхитительные девушки со всего двора предлагают прибегнуть, употребить к услугами сексуального характера по разумным ценам.
Источник
Методы отбора проб воздуха и приборы
Санитарно-микробиологическое исследование воздуха можно разделить на 4 этапа:
2) обработка, транспортировка, хранение проб, получение концентрата микроорганизмов (если необходимо);
3) бактериологический посев, культивирование микроорганизмов;
4) идентификация выделенной культуры.
Правильное взятие проб гарантирует точность исследования. В закрытых помещениях точки отбора проб устанавливаются из расчета на каждые 20 м 2 площади — одна проба воздуха, по типу конверта: 4 точки по углам комнаты (на расстоянии 0,5 м от стен) и 5-я точка — в центре. Пробы воздуха забираются на высоте 1,6—1,8 м от пола — на уровне дыхания в жилых помещениях. Пробы необходимо отбирать днем (в период активной деятельности человека), после влажной уборки и проветривания помещения. Атмосферный воздух исследуют в жилой зоне на уровне 0,5—2 м от земли вблизи источников загрязнения, а также в зеленых зонах (парки, сады и т.д.) для оценки их влияния на микрофлору воздуха.
Следует обратить внимание на то, что при отборе проб воздуха во многих случаях происходит посев его на питательную среду.
Все методы отбора проб воздуха можно разделить на седиментационные и аспирационные.
Седиментационный — наиболее старый метод, широко распространен благодаря простоте и доступности, однако является неточным. Метод предложен Р. Кохом и заключается в способности микроорганизмов под действием силы тяжести и под влиянием движения воздуха (вместе с частицами пыли и капельками аэрозоля) оседать на поверхность питательной среды в открытые чашки Петри. Чашки устанавливаются в точках отбора на горизонтальной поверхности. При определении общей микробной обсемененности чашки с мясопептонным агаром оставляют открытыми на 5—10 мин или дольше в зависимости от степени предполагаемого бактериального загрязнения. Для выявления санитарно-показательных микробов применяют среду Гарро или Туржецкого (для обнаружения стрептококков), молочно-солевой или желточно-солевой агар (для определения стафилококков), суслоагар или среду Сабуро (для выявления дрожжей и грибов). При определении санитарно- показательных микроорганизмов чашки оставляют открытыми в течение 40—60 мин.
По окончании экспозиции все чашки закрывают, помещают в термостат на сутки для культивирования при температуре, оптимальной для развития выделяемого микроорганизма, затем (если этого требуют исследования) на 48 ч оставляют при комнатной температуре для образования пигмента пигментообразующими микроорганизмами.
Седиментационный метод имеет ряд недостатков: на поверхность среды оседают только грубодисперсные фракции аэрозоля; нередко колонии образуются не из единичной клетки, а из скопления микробов; на применяемых питательных средах вырастает только часть воздушной микрофлоры. К тому же этот метод совершенно непригоден при исследовании бактериальной загрязненности атмосферного воздуха.
Более совершенными методами являютсяаспирационные, основанные на принудительном осаждении микроорганизмов из воздуха на поверхность плотной питательной среды или в улавливающую жидкость (мясо-пептонный бульон, буферный раствор, изотонический раствор хлорида натрия и др.). В практике санитарной службы при аспирационном взятии проб используются аппарат Кротова, бактериоуловитель Речменского, прибор для отбора проб воздуха (ПОВ-1), пробоотборник аэрозольный бактериологический (ПАБ-1),бактериально-вирусный электропреципитатор (БВЭП-1), прибор Киктенко, приборы Андерсена, Дьяконова, МБ и др. Для исследования атмосферы могут быть использованы и мембранные фильтры № 4, через которые воздух просасывается с помощью аппарата Зейтца. Большое разнообразие приборов свидетельствует об отсутствии универсального аппарата и о большей или меньшей степени их несовершенства.
Прибор Кротова. В настоящее время этот прибор широко применяется при исследовании воздуха закрытых помещений и имеется в лабораториях
Аппарат Кротова
Принцип работы аппарата Кротова (рис. 22) основан на том, что воздух, просасываемый через клиновидную щель в крышке аппарата, ударяется о поверхность питательной среды, при этом частицы пыли и аэрозоля прилипают к среде, а вместе с ними и микроорганизмы, находящиеся в воздухе.
Бактериально-вирусный электропреципитатор (БВЭП-1). Прибор основан на аспирационно-ионизационном принципе действия. БВЭП-1 состоит из осадительной камеры, в которую вмонтированы электроды: отрицательный в виде приводящей трубки, через которую поступает воздух (и частички аэрозоля соответственно заряжаются отрицательно), и положительный, на котором оседают бактерии.
Прибор МБ. Этот прибор служит не только для определения общей микробной обсемененности, но и для отбора проб воздуха с аэрозольными частицами различных размеров. Прибор МБ построен по принципу «сита» и представляет собой цилиндр, разделенный на 6 горизонтальных полос, на каждую из которых помещают чашки Петри с МПА. Воздух просасывается, начиная с верхней ступени, в пластине которой отверстия самые крупные, и чем ниже ступень, тем меньше размером отверстия (через последние проходят только тонкодисперсные фракции воздушного аэрозоля). Прибор рассчитан на улавливание частиц аэрозоля размером более 1 мкм при скорости отбора воздуха 30 л/мин. Уменьшение числа отверстий обеспечивает более равномерное распределение по питательной среде аэрозоля из воздуха. Для улавливания еще более мелких частиц аэрозоля можно добавлять дополнительно фильтр из фильтрующего материала АФА.
При использовании любого из перечисленных приборов получаемые результаты являются приблизительными, однако они дают более правильную оценку обсемененности воздуха в сравнении с седиментационным методом. Поскольку и отбор и санитарно-микробиологические исследования воздуха не регламентированы ГОСТ, то можно использовать любой прибор для оценки бактериальной загрязненности воздуха. Во многих случаях отбор проб совмещен с этапом посева.
Для снижения численности микроорганизмов в воздухе закрытых помещений применяют следующие средства: а) химические — обработка озоном, двуокисью азота, распыление молочной кислоты, б) механические — пропускание воздуха через специальные фильтры, в) физические — ультрафиолетовое облучение.
Источник
Полное меню
Основные ссылки
Вернуться в «Каталог СНиП»
МУК 4.2.1775-03 Метод микробиологического измерения концентрации клеток микроорганизма Trichoderma viride 44-11-62/3 — продуцента комплекса целлюлолитических ферментов в атмосферном воздухе населенных мест.
УТВЕРЖДАЮ
Главный государственный санитарный врач Российской Федерации,
Первый заместитель Министра здравоохранения Российской Федерации
Дата введения: 1 декабря 2003 г.
4.2. МЕТОДЫ КОНТРОЛЯ.
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Метод микробиологического измерения концентрации
клеток микроорганизма Trichoderma viride 44-11-62/3 —
продуцента комплекса целлюлолитических ферментов
в атмосферном воздухе населенных мест
Методические указания
МУК 4.2.1775-03
1. Общие положения и область применения
Настоящие методические указания устанавливают методику проведения микробиологического количественного анализа концентрации клеток штамма — Trichoderma viride 44-11-62/3 — продуцента комплекса целлюлолитических ферментов (целлюлаза, ксиланаза) в атмосферном воздухе населенных мест в диапазоне концентраций от 100 до 5 000 клеток в 1 м 3 воздуха.
Методические указания разработаны в соответствии с требованиями ГОСТ 17.2.4.02-81 «Охрана природы. Атмосфера. Общие требования к методам определения загрязняющих веществ» и Р 8.563-96 «Методики выполнения измерений».
Методические указания предназначены для применения в лабораториях предприятий, организаций и учреждений, аккредитованных в установленном порядке на право проведения микробиологических исследований.
Методические указания одобрены и рекомендованы секцией «Гигиенические аспекты биотехнологии и микробного загрязнения окружающей среды» Проблемной комиссии «Научные основы гигиены окружающей среды».
2. Характеристика штамма-продуцента
Trichoderma viride 44-11-62/3
На агаризованной среде сусло-агар (содержание солодового сусла 5-6° по Баллингу) на 5 день развития микроорганизм образует характерные колонии до 5,0-5,5 см в диаметре с гладкой подошвой, слегка приподнятые над поверхностью среды, не врастающие в агар, с волнистым краем, пушистым воздушным мицелием, который покрыт спорами лимонно-желтого цвета. На 3 день развития в среду выделяется ярко-желтый пигмент лимонного оттенка. Гифы мицелия бесцветные, септированные, многократно ветвистые.
Систематическое положение микроорганизма
Штамм Trichoderma viride 44-11-62/3 получен во ВНИИбио-технология в лаборатории Биосинтеза ферментов методом индуцированной селекции с применением этиленимина и нитрозометилмо-чевины из исходной культуры Trichoderma viride 44 — продуцента целлюлозы и депонирован в ЦМПМ ВНИИгенетика.
Штамм-продуцент синтезирует высокоактивный комплекс целлюлолитических ферментов для производства ферментного препарата целловиридин ГЗх. Максимальная активность целлюлазы составляет 35 ед/мл, ксиланазы — 42 ед/мл .
Штамм-продуцент растет на жидких и агаризованных средах. Культивирование гриба происходит 5 суток при температуре 36- 38 °С, затем 5 суток при комнатной температуре. Для размножения и хранения используется сусло-агар 5-6 °Б, рН среды — 5,0-6,0.
Предельно допустимая концентрация (ПДК) в атмосферном воздухе населенных мест — 200 кл/м 3 , пометка А.
3. Пределы измерений
Методика обеспечивает выполнение измерений количества клеток штамма-продуцента в атмосферном воздухе в диапазоне концентраций от 100 до 5 000 клеток в 1 м3 воздуха при доверительной вероятности 0,95.
4. Метод измерений
Прямой метод измерения концентрации штамма-продуцента основан на аспирации из воздуха микробных клеток (спор, фрагментов мицелия) на поверхность плотной питательной среды сусло-агар и подсчета выросших колоний по культурально-морфологическим признакам на день развития.
Косвенный метод измерения концентрации штамма-продуцента основан на аспирации из воздуха микробных клеток на поверхность плотной питательной селективной среды и подсчета выросших колоний по зонам просветления, образующихся вокруг каждой колонии штамма, как результат продукции целлюлазы на среде с окрашенной целлюлозой.
5. Средства измерений, вспомогательные устройства, реактивы и материалы
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства и материалы.
5.1. Средства измерений, вспомогательные устройства, материалы
Прибор для бактериологического анализа воздуха, модель 818(щелевой прибор Кротова)
Термостаты электрические суховоздушные или водяные
Бокс, оборудованный бактерицидными лампами
Весы лабораторные, аналитические типа ВЛА-200
Микроскоп биологический с иммерсионной системой типа «Биолам» Л-211
Чашки Петри бактериологические плоскодонные, стеклянные, диаметром 100мм
Пробирки биологические, вместимостью20 и 35 мл
Пипетки мерные на 1,5 и 10 мл
Пипетки мерные на 1,5 и 10 мл
Колбы конические, вместимостью 250 и 500 мл
Вата медицинская гигроскопическая
Агаризованное пивное сусло 5 — 6 °Б для штамма-продуцента (агар — 1 ,8 %, рН 5,0 — 6,0
режим стерилизации 1,1 — 1,2 ати в течение 30 мин
Молочная кислота, синоним-альфа-оксипропионовая кислота (из расчета 0,4 мл на 100 мл среды
сусло-агар для подавления посторонней бактериальной флоры)
Спирт этиловый ректификат
Селективная среда для штамма-продуцента, состав среды: КН2РО4 — 1 г; MgSCО4Н2О 0,5 г;
(NH4)2SO4— 0,7 г; целлюлоза порошковая в пересчете на сухое вещество — 0,9 г; лактоза — 0,3 г.;
дрожжевой экстракт — 0,5 г; агар -18 г; вода дистиллированная — до 1 000 мл.
6. Требования безопасности
При выполнении измерений концентрации клеток штамма-продуцента в атмосферном воздухе соблюдают следующие требования:
6.1. Правила техники безопасности при работе с химическими реактивами по ГОСТ 12.1.005-88 ..
6.2. Электробезопасность при работе с электроустановками по ГОСТ 12.1.019-79 и инструкции по эксплуатации прибора.
6.3. «Инструкции по устройству, требованиям безопасности и личной гигиены при работе в микробиологических лабораториях предприятий микробиологической промышленности» (1977).
6.4. Все виды работ с реактивами проводят только в вытяжном шкафу при работающей вентиляции, работа с биологическим материалом осуществляется в боксе, оборудованном бактерицидными лампами.
7. Требования к квалификации операторов
К выполнению измерений и обработке их результатов допускают лиц с высшим или средним специальным образованием, прошедших соответствующую подготовку и имеющих навыки работы в области микробиологических исследований.
8. Условия измерений
Процессы приготовления растворов и подготовки проб к анализу проводят в нормальных условиях при температуре воздуха (20±5 °С), атмосферном давлении 630-800 мм рт. ст. и влажности воздуха не более 80 %.
9. Проведение измерения
9.1. Условия отбора проб воздуха
Для определения концентрации клеток штамма-продуцента воздух аспирируют при помощи аппарата Кротова со скоростью 10 л/мин на поверхность плотной питательной среды. Время аспирации воздуха (5-20 мин) зависит от предполагаемой концентрации клеток продуцента (прямой метод позволяет учитывать на чашке до 200 колоний продуцента, косвенный -до 30-50 колоний на чашке).
Аппарат Кротова перед каждым отбором пробы воздуха тщательно протирают спиртом. Особенно тщательно обрабатывают поверхность подвижного диска и внутреннюю стенку прибора, наружную и внутреннюю стенку крышки. На подвижной диск устанавливают подготовленную чашку Петри со средой, одновременно снимая с нее крышку. Прибор закрывают. Соприкосновение крышки прибора со средой недопустимо. После отбора пробы воздуха и остановки диска, прибор открывают, быстро снимают чашку Петри и закрывают крышкой от данной чашки. На дне чашки Петри стеклографом отмечают точку контроля, время аспирации и дату отбора пробы.
При выполнении анализа воздуха прямым методом среду сусло-агар расплавляют, остужают до 50-60 °С, добавляют молочной кислоты из расчета 0,4 мл на 100 мл среды (для подавления посторонней бактериальной микрофлоры), тщательно перемешивают и разливают в чашки Петри.
При выполнении анализа воздуха косвенным методом селективную среду расплавляют, остужают до 60 °С, добавляют 50 мг/л бенгальского розового, растворенного в 1 мл диметилсульфоксида, тщательно перемешивают и разливают по 10 мл в стеклянные чашки Петри на горизонтальной поверхности. Бенгальский розовый предназначен для специфического окрашивания целлюлозы и для ограничения разрастания колоний на чашках.
Чашки с застывшей средой помещают в термостат на сутки при температуре 37 о С, после чего проросшие чашки бракуют, стерильные чашки используют для контроля воздуха.
После отбора проб воздуха чашки Петри помещают в термостат на 42 °С (для интенсификации развития гриба). Через 3 суток производят подсчет выросших колоний по культурально-морфологическим признакам и характерной пигментации среды (прямой метод) или зон просветления вокруг выросших колоний продуцента (косвенный метод), как результат продукции целлюлолитических ферментов на среде с окрашенной целлюлозой.
10. Вычисление результатов измерения
Расчет концентрации клеток продуцента в пересчете на 1 м’ воздуха производят по формуле:
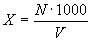
Х — концентрация клеток продуцента в воздухе,
N — количество колоний продуцента, выросших на чашке,
1 000 — коэффициент пересчета на 1 м 3 воздуха,
V — объем воздуха, л (произведение скорости на время аспирации).
11. Оформление результатов измерений
Результаты измерений оформляют протоколом по форме.
Протокол №
количественного микробиологического анализа
штамма-продуцента Trichoderma viride44-11-62/3
в атмосферном воздухе населенных мест
1. Дата проведения анализа______________
2. Место отбора пробы__________________
4.Юридический адрес организации_______
Результаты микробиологического анализа
Источник












